РАССТАНОВКА КОЭФФИЦИЭНТОВ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а) водорода: 8NH3, NaOH, 6NaOH, 2NaOH, НзРО4, 2H2SO4, 3H2S04, 8H2SO4;
6) кислорода : C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
А1 + О2→ А12О3А1-1 атом А1-2
О-2 атома О-3
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
6:2 = 3
Аl + ЗО 2 →Аl 2 О 3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О 2 →2А1 2 О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 + ЗО 2 → →2А1 2 О 3
А1 -1 атом А1 - 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО 2 → →2А1 2 О 3
. Первичная проверка усвоения знаний(8-10 мин .).
В левой части схемы два атома кислорода, а в правой - один. Число атомов нужно выровнять с помощью коэффициентов.
1)2Mg+O 2 →2MgO
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1. Fe 2 O 3 + А l → А l 2 О 3 + Fe; Mg + N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1 + С → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr + Al 2 O 3 ; Ca + P → Ca 3 P 2 ;
4. С + H 2 → CH 4 ; Ca + С → СаС 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na + S → Na 2 S; CaO + С → CaC 2 + CO;
7. Ca + N 2 → C a 3 N 2 ; Si + Cl 2 → SiCl 4 ;
8. Ag + S → Ag 2 S; Н 2 + С l 2 → НС l;
9. N 2 + O 2 → NO; СО 2 + С → СО ;
10. HI → Н 2 → + 1 2 ; Mg + НС l → MgCl 2 + Н 2 ;
11. FeS + НС 1 → FeCl 2 + H 2 S; Zn+ HCl → ZnCl 2 + H 2 ;
12. Br 2 + KI → KBr+ I 2 ; Si + HF (r) → SiF 4 + H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 + S → → KCl+ SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + С → Si + CO;
15. SiO 2 + С → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16 .
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Для того чтобы выяснить, как уравнять химическое уравнение, для начала следует узнать предназначение данной науки.
Определение
Химия изучает вещества, их свойства, а также превращения. В случае если не наблюдается изменения окраски, выпадения осадка, выделения газообразного вещества, то не происходит никакого химического взаимодействия.
Например, при обработке напильником железного гвоздя металл просто превращается в порошок. В этом случае никакой химической реакции не происходит.
Прокаливание перманганата калия сопровождается образованием оксида марганца (4), выделением кислорода, то есть наблюдается взаимодействие. При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.

Специфика химических превращений
Любые явления, которые сопровождаются изменением качественного и количественного состава веществ, относятся к химическим превращениям. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов.
Методика расстановки коэффициентов
Как уравнивать коэффициенты в химических уравнениях? В курсе химии средней школы разбирается метод электронного баланса. Рассмотрим процесс более подробно. Для начала в исходной реакции необходимо расставить степени окисления у каждого химического элемента.
Существуют определенные правила, по которым их можно определить у каждого элемента. В простых веществах степени окисления будут равны нулю. В бинарных соединениях у первого элемента она положительна, соответствует высшей валентности. У последнего данный параметр определяется путем вычитания номера группы из восьми и имеет знак «минус». В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
Для первого и последнего элемента порядок аналогичен определению в бинарных соединениях, а для вычисления центрального элемента составляется уравнение. Сумма всех показателей должна быть равна нулю, исходя из этого, вычисляется показатель для среднего элемента формулы.
Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. После того как степени окисления будут поставлены, можно определять те ионы либо вещества, которые в ходе химического взаимодействия изменили их значение.
Знаками «плюс» и «минус» необходимо указать количество электронов, которые были приняты (отданы) в процессе химического взаимодействия. Между полученными цифрами находят наименьшее общее кратное.
При делении его на принятые и отданные электроны получают коэффициенты. Как уравнять химическое уравнение? Полученные в балансе цифры нужно поставить перед соответствующими формулами. Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.

Закон сохранения массы веществ
Рассуждая над тем, как уравнять химическое уравнение, необходимо использовать именно этот закон. Учитывая, что масса тех веществ, которые вступили в химическую реакцию, равна массе образующихся продуктов, становится возможным постановка коэффициентов перед формулами. Например, как уравнять химическое уравнение, если вступают во взаимодействие простые вещества кальций и кислород, а после завершения процесса получается оксид?
Чтобы справиться с поставленной задачей, необходимо учитывать, что кислород является двухатомной молекулой с ковалентной неполярной связью, поэтому его формула записывается в следующем виде - О2. В правой части при составлении оксида кальция (СаО) учитывают валентности каждого элемента.
Сначала необходимо проверить количество кислорода в каждой части уравнения, так как оно отличается. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
- 2Са+О2=2СаО.

Разбор реакции методом электронного баланса
Как уравнивать химические уравнения? Примеры ОВР помогут ответить на данный вопрос. Допустим, что необходимо методом электронного баланса расставить коэффициенты в предложенной схеме:
- CuO + Н2=Cu + Н2О.
Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Получим следующий вид уравнения:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показатели изменились у меди и водорода. Именно на их основе будем составлять электронный баланс:
- Cu(+2)+2е=Cu(0) 1 восстановитель, окисление;
- Н2(0)-2е=2Н(+) 1 окислитель, восстановление.
Исходя из коэффициентов, полученных в электронном балансе, получаем следующую запись предложенного химического уравнения:
- CuO+Н2=Cu+Н2О.
Возьмем еще один пример, который предполагает постановку коэффициентов:
- Н2+О2=Н2О.
Для того чтобы уравнять на основе закона сохранения веществ данную схему, необходимо начать с кислорода. Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
- 2Н2+О2=2Н2О.

Заключение
На основании электронного баланса можно расставлять коэффициенты в любых химических уравнениях. Выпускникам девятых и одиннадцатых классов образовательных учреждений, выбирающим экзамен по химии, в одном из заданий итоговых тестов предлагают подобные задания.
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
Определим степени окисления атомов в молекулах:
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
Перенесем коэффициенты в основное уравнение:
Уравняем число атомов, не меняющих степень окисления:
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород .
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства
.
Важнейшими восстановителями являются
оксид углерода
 ,
сероводород
,
сероводород ,
сульфат железа(II)
,
сульфат железа(II)
 .Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
.Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
 ,
дихромат калия
,
дихромат калия ,
пероксид водорода
,
пероксид водорода ,
азотная кислота
,
азотная кислота ,
концентрированная серная кислота
,
концентрированная серная кислота .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
 сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
а при взаимодействии с сероводородом является окислителем:

Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
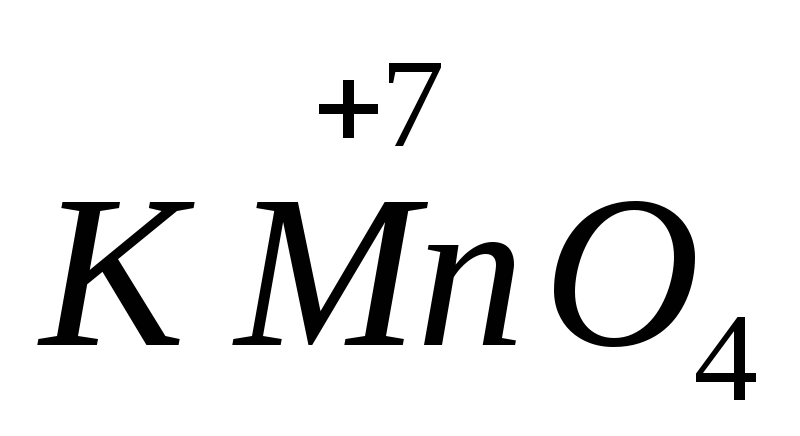 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до ,
в нейтральной до
,
в нейтральной до ,
в присутствии серной кислоты - до
,
в присутствии серной кислоты - до .
.
Православные священнослужители о кризисе российского образования …
28 августа в Москве на Пушкинской площади прошла акция в поддержку качественного бесплатного образования в России. Организаторами митинга выступили движение «Возрождение. Золотой век», Всероссийский фонд образования и представители педагогического сообщества. Участники митинга заявили, что реформы Андрея Фурсенко нанесли вред отечественной системе образования и потребовали скорейшей отставки министра.
Как отмечает издание, в последние годы Россия потеряла лидирующие позиции по качеству образования в рейтинге ЮНЕСКО. Сейчас по этому показателю наша страна находится на 54-й позиции. Преподавательский состав стремительно стареет: в 1980-х средний возраст педагога составлял 35 лет, на рубеже 2000-х – 50 лет. Директор центра проектирования школьных систем ВШЭ Анатолий Каспржак сообщил, что к 15 годам 30% школьников не умеют читать: «Они произносят знаки, но они не понимают, что за ними стоит». Он же отметил, что образование перестало быть «социальным лифтом». Поскольку в наше время ни диплом, ни полученные знания не обеспечивают ни уровня жизни, ни социального статуса, они ценятся все меньше.
В связи с этим корреспондент издания попросил православных священнослужителей порассуждать над тем, что следовало бы прежде всего сделать для выхода из кризиса в сфере образования.
Кризис образования носит системный характер, считает главный редактор журнала «Наследник» протоиерей Максим Первозванский. «Связано это с отсутствием понимания, куда двигаться нашей стране. Пока нет общей системы государственного строительства, метания в сфере образования - и не только - будут продолжаться», - сказал он. «Еще одной причиной является нерациональное вложение денег в развитие преобразований. Например, на непонятную реформу и принятие ЕГЭ средства находятся», - добавил священник. «Престиж школы падает и из-за низкой зарплаты педагогов. Кто сейчас поступает в педагогический институт? Те, кто никуда не смог больше поступить. Энтузиастов, которые действительно идут туда по призванию, становится все меньше, это единицы», - считает пастырь. «Должно быть так, чтобы в учителя шли лучшие люди, которые не тратили бы свое время и силы на огромные нагрузки, беря по 2-3 ставки. Зарплата должна быть минимум в пять раз выше нынешней. И все эти проблемы вполне решаемы, если подходить к ним обдуманно и взвешенно», - заключил отец Максим.
Протоиерей Александр Ильяшенко, настоятель храма Всемилостивого Спаса бывшего Скорбященского монастыря на Новослободской, также находит нынешнее состояние образования в России весьма плачевным. «Людей, вышедших на митинг, я поддерживаю. Образование - это наше национальное достояние. Это одно из дел первостепенной важности. К образованию нельзя относиться с критерием «числом поболее, ценою подешевле». Вкладывая деньги в приобретение зарубежных технологий, мы на самом деле приобретаем достижения вчерашнего дня, а развивая качественное доступное образование, мы получим достижения дня завтрашнего», - сказал он. «На протяжении нескольких десятилетий наша система образования по праву считалась одной из лучших в мире. Во всех сферах культуры и науки наши достижения были значительны и бесспорны. Правительство должно прикладывать все силы, чтобы это достояние хранить и преумножать. Всем вместе нужно искать пути выхода из этого системного кризиса. Кризис этот уже слишком глубокий и обширный. Выход из него является задачей государственной важности», - заключил он.
Протоиерей Максим Козлов, настоятель домового храма МГУ, отметил, что в высшей школе дела идут не лучше, чем в средней. «Состояние высшей школы нельзя охарактеризовать иначе как кризисное. Во многом это связано с обилием псевдоуниверситетов и псевдовузов, обилием надуманных и ненужных специальностей. Все это нужно резко сократить», - сказал он. «Высшее образование представляется большинству школьников как бы естественным продолжением среднего. Но получить серьезное высшее образование объективно способны не более 20% выпускников средней школы. Происходит фальсификация. Для поднятия уровня высшего образования необходимо отчислять всех неспособных студентов по результатам первой сессии или первого года обучения, - а у нас такого даже представить себе не могут», - констатировал протоиерей. «Система ЕГЭ в корне порочна. Уже только в силу федеративного устройства и отсутствия должного контроля положительный результат достигнут не будет», - добавил он.
Иеромонах Тихон (Зимин), преподаватель МДАиС, видит в кризисе образования последствия слепого копирования западных моделей. «Проблемы в нашем образовании связаны, на мой взгляд, с тем, что реформаторы ориентируются на западные стандарты, отказываясь от наших собственных, вполне успешных, традиций образования. И вот дети перестают читать, аналитически мыслить и вникать в сущность проблем, а хотят скользить по верхам. Везде звучит установка, что дети перегружены, что нужно сокращать программы. В результате мы получаем людей малообразованных, не способных к осмыслению ситуации, но способных только потреблять и потреблять», - сказал он. «Это одна из важнейших стратегических проблем. Разумеется, дать бесплатное образование высокого качества поголовно всем детям государство не в состоянии. Но оно должно, по крайней мере, предусмотреть возможность получения его детьми способными. К сожалению, такой программы нет. Та, что есть, рассчитана на общий средне-низкий уровень, а хорошее, но платное образование не по карману бедным семьям. Вот и получается, что хорошее образование недоступно способным, но бедным детям, но доступно неспособным, но богатым», - отметил пастырь. «Безусловно, система государственного бесплатного образования, опирающаяся на лучшие отечественные и зарубежные образцы, должна существовать. Но пока, к сожалению, разрушается и то хорошее, что еще осталось. Если государство не решит эту проблему, мы останемся без будущего», - с грустью заключил отец Тихон.
Черная полоса может стать взлетной
Время от времени все мы сталкиваемся с проблемами. Порой некоторые ситуации и обстоятельства кажутся нам безвыходными. Хочется убежать, закрыться, забыть всё произошедшее. Но стоит ли?
Ведь тогда урок повторится вновь. Есть ещё способ уйти в проблему, думать о ней день и ночь, лить слёзы, залить её, запить или заесть, в общем, чем-нибудь замаскировать. И найти виноватых!
Жалобы на проблему и поиск виноватых также только отнимут наши силу и энергию и уведут от решения проблемы.
Важно также помнить, что чем больше мы будем сопротивляться, тем более будет нагнетаться и усложняться ситуация.
Нужно найти выход! И лучше не один. Как говорится, из любой безвыходной ситуации есть как минимум три благоприятных выхода .
Какие же существуют способы решения проблем, и как выбрать наиболее подходящий, а может, сочетать их?
1. Взгляд со стороны.
Этот метод предполагает самостоятельный поиск информации. За всю свою историю человек нашел решение великому множеству проблем. И результаты своих решений он фиксировал на материальных носителях: папирусе, бумаге, камне, компьютере.
При решении проблемы целесообразно, в первую очередь, самостоятельно обратиться к источникам бесконечной информации.
2. Обратиться к специалисту.
Мы живем в обществе, нас окружают тысячи людей, каждый из которых является экспертом в какой-то области. Психолог, таролог, астролог, коуч, экстрасенс, есть даже специалисты по решению проблем.
Специалист по решению «проблем вообще» отличается от них лишь тем, что работает с проблемами, которые требуют не обширных познаний и большого опыта в узкой области, а лишь сообразительности, аккуратности, здравого смысла, кое-каких базовых представлений, общего навыка работы с проблемами и, конечно же, вдохновения.
Несомненно, с возникшей у вас проблемой уже кто-то сталкивался. Скорее всего, они уже были когда-то кем-то решены, и причем много раз.
Работа профессионала экономит ваши время и нервы, однако хороший профессионал стоит дорого, и может выработаться зависимость от психолога, когда человек как не решал свои проблемы, так и не решает.

3. Попросить о помощи близких вам людей.
Этот способ решения проблем является одним из самых традиционных. Способ достаточно надёжный, так как это люди, общение с которыми доставляет вам удовольствие. Часто такое общение может успокоить, дать поддержку.
Расскажите родным, друзьям, людям, которым вы действительно доверяете. Они всегда будут готовы помочь – советом, делом. Это намного лучше, чем утопать в негативных мыслях и переживаниях.
Это хорошая возможность получить «взгляд со стороны». Главное – не быть назойливым и самому всегда быть готовым оказать подобную помощь.
4. Сменить фокус.
Часто мы слишком близко и слишком эмоционально вовлечены в проблему, чтобы увидеть и оценить ее с хорошей перспективы. Попытайтесь смотреть на проблему как сторонний наблюдатель. При более широком обзоре вы увидите больше возможностей.
Часто мы думаем о проблеме, смакуем ее в мозгу, сосредоточены на ней, но она не решается. Мы пытаемся решить умом, заглушая интуицию. Чтобы она решилась, надо убрать с проблемы внимание, убрать важность.
Содержимым автоматического письма очень часто бывают рисунки, непонятные знаки, круги и, конечно, тексты.
Вам остаётся только записывать всё, что приходит в голову. Делать это необходимо от 20 минут до часа. Основной смысл и цель процесса автоматического письма – отдаться потоку воспринимаемых вами ощущений.
Понимание проблемы и выход из нее придет в самом письме.

6. Хоопонопоно.
Хоопонопоно – это древнее гавайское искусство решения проблем. В переводе с гавайского языка слово «хоопонопоно» означает «исправить ошибку» или «расставить всё по местам». Существуют четыре утверждения, которые вы должны повторять снова и снова, безостановочно:
«Мне очень жаль».
«Пожалуйста, прости меня».
«Я люблю тебя».
«Благодарю тебя».
Если вам не нравится что-то в другом человеке, значит, это есть и в вас. Ваша задача - избавиться от этого. Когда вам это удастся, другой человек также изменится.
Когда вы применяете Хоопонопоно, вы не очищаете человека, место или событие, а нейтрализуете энергию, связанную с этим человеком, местом или событием. Плюсом этого метода является то, что всё происходит внутри вас, посредник не нужен.

7. Расстановки.
Этот метод разработан немецким психотерапевтом Бертом Хеллингером. Расстановка – это результативный метод, позволяющий легко и наглядно определить проблему.
С помощью этого метода можно обнаружить причины, которые привязывают человека к определенной системе отношений, ограничивают свободу действий и затрудняют личное развитие, мешая ему строить собственную жизнь.
С помощью расстановки можно провести анализ происходящего с вами, найти действенное решение в вашей ситуации и

8. Реинкарнационика.
«Если появилась проблема, нужно в нее глубоко погрузиться. Тогда ты либо найдешь сокровище, если оно там вообще есть, либо обнаружишь там одну пустоту. В обоих случаях ты обогатишься.
Обнаружив сокровище, ты, естественно, разбогатеешь. Обнаружив пустоту, ты покончишь со всем этим », – это Ошо как будто о реинкарнационике.
Именно погружение в себя, в свои воспоминания предполагает этот метод. Здесь не может быть чужих ответов, готовых решений. Реинкарнационика ищет корень проблемы, причём сквозь время и пространство. А дальше дело за малым – решение.
Владимир Жикаренцев:
Если у нас хватило сил создать проблему или болезнь в своей жизни, следовательно, у нас есть силы решить эту проблему.
Вспоминая прошлые жизни , вы поймёте, что справлялись с подобной проблемой уже не раз, а если нет, то осознаете, к какому результату привёл тот подход, который вы уже использовали. Возможно, повторяющаяся ситуация тянется не одну жизнь.
Часто проблема, блок хранят ресурс, творческий потенциал, то самое сокровище, обнаружив которое, вы уже не будете прежним. И не важно, где и когда вы его оставили, оно ваше, и в любой момент вы можете им воспользоваться.
Всё, что вам нужно для того, чтобы воспользоваться этим методом решения проблем – это доверие себе, хороший проводник и Интернет.
Реинкарнационика также предполагает самопомощь, самопогружение, а это значит, вы сами можете стать специалистом по решению проблем и помогать другим.

Выход есть всегда. И самое удивительное заключается в том, что он вам известен. Вы знаете, как решить самую сложную проблему, как вам найти выход из самой трудной и запутанной ситуации.
Можно и нужно учиться у проблем, создавать и обнаруживать те возможности, которые иначе не были бы раскрыты.